魚の卵を用いたノロウイルスの人工合成法の確立
(Kotaki et al., 2025, PNAS, 122(49):e2526726122)
NHKニュース、朝日新聞、毎日新聞、日本経済新聞、日刊工業新聞、その他、国内外の多数のメディアに紹介されました。
ノロウイルスは急性胃腸炎を引き起こすウイルスで、その感染者数や社会的損失の大きさから、最も重要な腸管感染症の原因ウイルスの一つです。し かし、そのワクチンや治療薬の開発は遅れています。その要因として、ノロウイルスでは人工合成法の開発の遅れが挙げられます。近年、ノロウイルスの培養にはヒトの腸の細胞から作ったミニ腸(ヒト腸管オルガノイド)が使われていますが、技術的に難しくコストも高く、ウイルス増殖も効率的とは言えないことが課題で した。そのような中、ゼブラフィッシュ(*1)という小型魚類がノロウイルスの培養に適していることが報告され、注目を集めていました。
本研究では、ゼブラフィッシュの卵(胚)(*2)を用いることで、感染性のあるノロウイルスを人工的に作り出すことに世界で初めて成功しました。まず、ノロウイルスゲノム由来のcDNAを組み込んだプラスミドを培養細胞に導入し、培養上清をマイクロインジェクション(*3)によりゼブラフィッシュ胚に注入することでウイルスの作製に成功しました。
これは、培養細胞とゼブラフィッシュ胚を組み合わせることで、感染性ノロウイルスの産生を実証した重要な成果です。さらに、培養細胞を介さずにゼブラフィッシュの胚に直接ノロウイルス cDNA を組み込んだプラスミドをマイクロインジェクションにより注入するという新しい手法を確立し、より高効率かつ簡便にノロウイルスを作製できることを示しました。また、この技術を用いて、任意の変異を導入したウイルスや、化学発光タンパク質遺伝子を含むウイルスの作製にも成功しました。
本研究で確立した技術は、魚の胚の中でノロウイルスのようなヒトに病気を引き起こすウイルスを作るという、これまでにない新しい技術です。本研究の成果により、ノロウイルスの増殖機構の解明と新規ワクチン開発研究が飛躍的に進展することが期待されます。ノロウイルスゲノムに任意の変異を導入できるようになったことで、ウイルス複製に重要な遺伝子を同定することが可能となります。得られた情報に基づき、増殖性や病原性を弱めたウイルスを作製することが可能となり、新規ワクチンとしての応用が期待されます。さらに、本技術を用いて感染に伴っ て発光するノロウイルスの作製にも成功しました。このようなウイルスを用いることで、ウイルス感染量を簡便に可視化・定量化でき、抗ウイルス活性の評価が容易となるため、抗ウイルス薬の開発を大幅に加速させることが期待されます。
(*1) ゼブラフィッシュ ヒマラヤ周辺の温帯地域に生息するコイ科の淡水魚。胚発生が早い、ヒトと類似した遺伝子・臓器を 持つ、飼育が容易などの理由からモデル動物として使用されている。近年、ヒトノロウイルスがゼブ ラフィッシュで効率よく増殖することが報告され、ウイルス研究者から注目を集めていた。
(*2) 卵(胚) 多細胞生物が受精卵から細胞分裂を繰り返しながら成長する初期段階の状態。
(*3) マイクロインジェクション 微小な針で細胞や受精卵に、ごく少量の試料を直接注入する実験手法。
より安全で効果的なロタウイルスワクチンの基盤を開発
(Kotaki et al., 2025, PLos Pathogens, 21(9):e1013484 )
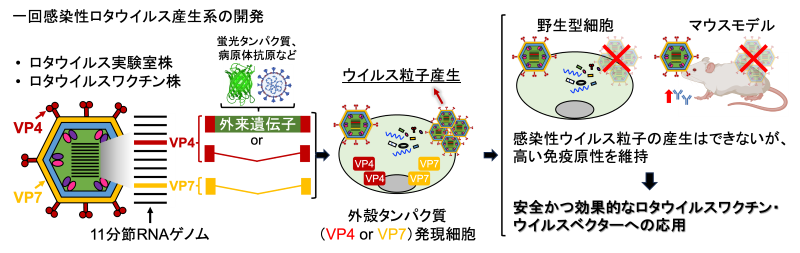
ロタウイルスは乳幼児に急性の胃腸炎を引き起こし、世界では毎年約13万人の子どもが命を落としています。現在承認されている弱毒生ワクチンは効果的ですが、生体内で増殖するため安全性への懸念も残っています。
研究チームは、ウイルス増殖に必要な外殻タンパク質(VP7またはVP4)をコードする遺伝子を欠損させ、生体内で増殖することのできない「一回感染型」ロタウイルスの作製に成功しました。さらに、ヒトに病原性のないワクチン株(WC3株)を基盤としたタイプも作製し、実用化に向けた安全性を一層高めました。
加えて、この一回感染型ロタウイルスに新型コロナウイルスの抗原や蛍光タンパク質などの外来遺伝子を組み込み、効率よく発現できることを確認しました。この技術は、ロタウイルス自体のワクチンだけでなく、他の感染症に対する経口ワクチン開発にも応用できると期待されます。
本成果は、より安全で効率的な経口ワクチンプラットフォームの実現に向けた重要な一歩です。
ワクチンや自然感染で生じた抗体から逃れやすいロタウイルス遺伝子型の特定
(Kotaki et al., 2025, mBio, 16(7):e0089725)
ロタウイルスは乳幼児に重い胃腸炎を起こし、世界では年間約13万⼈の子どもが亡くなっています。ロタウイルスはヒト以外にも多くの哺乳類に感染し、100種類以上に及ぶ「遺伝子型」が存在しています。このような多様性はヒトにおける流行株やワクチン効果に影響を及ぼすと考えられていますが、その詳細は明らかになっていませんでした。そこで研究チームは、ウイルスの表面タンパク質(VP4あるいはVP7)を入れ替えたロタウイルスを網羅的に人工合成し、遺伝子型ごとの抗体感受性を測定しました。その結果、VP7 の遺伝子型が抗体の効き方を左右する主な要因であり、特にコウモリ由来のロタウイルスの遺伝子型はワクチンや自然感染によって獲得された抗体を回避しやすいことが明らかになりました。さらに、VP7 の特定の領域(ドメイン I)が抗体感受性の決定部位であることも示しました。
本研究により、抗体が効きにくい遺伝子型を事前に特定し、監視体制を強化できる可能性が示唆されました。また、VP7 ドメイン I を標的とすることで、より有効なワクチン設計につながることが期待されます。これらの知見は、ロタウイルスワクチンの改良や将来の流行株を先回りして封じ込めるための重要な基盤となります。
コロラドダニ熱ウイルスの人工合成法の確立
(Minami et al., 2025, PLos Pathogens, 21(2):e1012921)
分節型二本鎖RNAゲノムを持つウイルスグループ(レオウイルス科)には、脊椎動物や無脊椎動物、植物、菌類など、幅広い宿主に感染する多様なウイルスが含まれます。この科に属するコロラドダニ熱ウイルスは、マダニを介してヒトに感染し、インフルエンザ様の高熱をはじめとする多様な症状を引き起こす、バイオセーフティーレベル3に分類される高病原性のウイルスです。このウイルスは、1940年代にアメリカで発見されて以来、人工的に作製する技術が確立されておらず、その研究の進展が遅れていました。
本研究では、コロラドダニ熱ウイルスの人工合成法を開発するために、まず、コロラドダニ熱ウイルスの12分節に分かれたウイルスゲノムを発現する12種類のプラスミド、およびウイルスの人工合成を促進するコロラドダニ熱ウイルスのタンパク質を発現する12種類のプラスミド、さらにワクシニアウイルス由来キャッピング酵素(*1)を発現する2種類のプラスミドを作製しました。これら26種類のプラスミドを同時に培養細胞(BHK-T7細胞)に導入し、コロラドダニ熱ウイルス高感受性細胞と共に培養することで、コロラドダニ熱ウイルスの人工合成に成功しました(図1)。さらに、コロラドダニ熱ウイルスの分節遺伝子に変異を加えた人工組換えウイルスや、レポーター遺伝子を発現するウイルスの作製にも成功しました。本研究成果により、コロラドダニ熱ウイルスの研究が飛躍的に進み、治療法や予防法の開発に繋がることが期待されます。
(*1) ワクシニアウイルス由来キャッピング酵素 ワクシニアウイルス由来のRNAキャッピング酵素(D1RおよびD12L)により、細胞質内で合成されたコロラドダニ熱ウイルスのRNAの5′末端にキャップ構造が付加され、タンパク質の翻訳効率が向上する。
コウモリ細胞でウイルス増殖を特異的に制御するウイルス性因子の発見
(Nouda et al., 2022, PLoS Pathogens, 18(6):e1010553)
コウモリはエボラウイルス、ニパウイルス、新型コロナウイルスなど、ヒトに感染することで重篤な症状をもたらすウイルスの自然宿主と考えられています。しかし、コウモリが病原性をほとんど示すことなく、これらのウイルスを保有できる仕組みは不明なところが多く、宿主因子やウイルス性因子がウイルス複製を調節しているのではないかと考えられています。本研究では、NBV p17タンパク質が核に移行し、NBVの自然宿主であるコウモリ細胞特異的に、細胞融合活性を有するNBV FASTタンパク質の機能を調節することで、ウイルス複製を制御していることを明らかにしました。本成果はウイルスとその自然宿主であるコウモリとの共生関係を理解する上で有用な知見であり、自然宿主におけるウイルスの複製や病原性の制御機構の解明に貢献することが期待されます。
12本に分かれたゲノムを持つウイルスの人工合成法の確立
(Nouda et al., 2021, PNAS, 118(42):e2105334118)
ウイルスには9から12本の分節に分かれたRNAゲノムを持つウイルスグループ(レオウイルス科)が知られています。レオウイルス科には乳幼児に下痢症を引き起こすロタウイルス(11分節ゲノム)やマダニに噛まれることによりヒトに感染するコロラドダニ熱ウイルス(*1)(12分節ゲノム)などの病原ウイルスが含まれています。これまで10本の分節RNAゲノムを持つレオウイルスや11本の分節ゲノムを持つロタウイルスにおいては人工的に任意の組換えウイルスを合成できる技術が既に開発されており、これらの技術を用いて、ウイルス学的研究が進められてきました。しかし、このウイルスグループで分節ゲノムの数が最も多い12分節のRNAゲノムを持つウイルスについては人工合成法が確立されておらず、長い間その開発が望まれていました。
12本の分節ゲノムを持つコロラドダニ熱ウイルスと同じウイルス属のタルミズダニウイルス(*2)の人工合成法の確立を行いました。タルミズダニウイルスの12分節に分かれたRNAゲノムを発現するプラスミドベクターを作製し、これら12種類の全てのプラスミドを同時に培養細胞に導入することでタルミズダニウイルスの人工合成に成功しました(図1)。さらにこの技術を用いて、タルミズダニウイルスの分節遺伝子に変異を加えた組換えウイルスやレポーター遺伝子を発現するウイルスの作製にも成功しました(図2)。
12分節のゲノムを持つRNAウイルスにはコロラドダニ熱ウイルスなどの病原ウイルスが含まれています。本研究成果により、これまでウイルス複製機序、病原性、ウイルス生活環が不明であった12分節のRNAゲノムを持つウイルスの研究が飛躍的に進み、治療法や予防法の開発につながることが期待されます。また、タルミズダニウイルスの人工合成法を用いて研究を進めることで、ウイルス学的知見が蓄積され、ヒトや動物に重篤な疾患を引き起こす他の分節ゲノムを持つRNAウイルスの研究にも広く貢献することが期待されます。
(*1) コロラドダニ熱ウイルス(Colorado tick fever virus) 12分節の二本鎖RNAをゲノムとして持つコロラドダニ熱ウイルスは、ヒトに発熱、悪寒、筋肉痛、腹痛などを引き起こすことが知られている。このウイルスを保有するマダニに咬まれることで感染する。
(*2 )タルミズダニウイルス(Tarumizu tick virus) 国内のキチマダニから最初に分離され、コロラドダニ熱ウイルスと同じレオウイルス科コルチウイルス属に分類される12本の分節RNAゲノムを有するウイルス。今回の研究では、国内の死亡したタヌキから分離されたウイルス株を用いて人工合成法の確立を行った。
細胞融合性タンパク質FASTによる新規ウイルス複製メカニズムの解明
(Kanai et al., 2019, PLoS Pathogens, 15(4): e1007675)
コウモリ由来高病原性レオウイルス(pteropine orthoreovirus: PRV)は、ヒト呼吸器疾患の原因ウイルスの一つとして知られています。PRVは、細胞融合活性を持つFAST(fusion associated small transmembrane protein)タンパク質をコードしており、感染細胞に強力な細胞融合を引き起こします。FASTタンパク質はレオウイルス科fusogenicレオウイルスグループのみがコードしており、ノンエンベロープウイルス(*1)に認められる唯一の細胞融合性ウイルスタンパク質として知られています。しかし、これまでウイルス複製サイクルにおけるFASTタンパク質の機能については全く分かっておりませんでした。
私達はFASTタンパク質の機能を調べるため、PRV Miyazaki-Bali/2007(MB)株の遺伝子操作系を用いて、FASTタンパク質を発現しない遺伝子組換えウイルス(rsMB-ΔFAST)の作製に成功し、FASTタンパク質がウイルス複製に必須では無いことを明らかにしました。rsMB-ΔFASTの増殖能は野生型PRVと比較し、顕著に低下しており、さらに、様々なFASTタンパク質変異ウイルスを作製し、解析した結果、FASTタンパク質による細胞融合活性がPRVの増殖促進に重要な役割を担っていることを明らかにしました。また、FASTタンパク質はFASTタンパク質を持たない分節型2本鎖RNAウイルスの複製を促進することも見出し、これまで不明であったFASTタンパク質のin vitroにおける機能を明らかにしました。
次いで、in vivoにおけるFASTタンパク質の機能について理解するため、動物モデルを用いて解析を行いました。その結果、野生型PRVはマウスに対して致死的な感染を引き起こしますが、rsMB-ΔFAST感染マウスは全く病原性を示さず、FASTタンパク質がPRVの高病原性に関与する主要因子であることが明らかとなりました。さらに、rsMB-ΔFAST感染マウスに野生型PRVを攻撃接種したところ、感染防御効果が認められ、ワクチン候補株として、rsMB-ΔFASTの有用性が示されました。FASTタンパク質変異ウイルスを用いたワクチン開発戦略は、他の病原性fusogenicレオウイルス(トリレオウイルスなど)に対しても応用可能であり、今後の研究の進展が期待されます。
(*1 )ノンエンベロープウイルス インフルエンザウイルスやHIVを含むエンベロープウイルス(enveloped virus)はウイルス粒子が感染細胞由来の脂質二重膜(エンベロープ)に覆われている。一方、レオウイルスを含むノンエンベロープウイルス(non-enveloped virus)のウイルス粒子はウイルスタンパク質のみで構成される。
ロタウイルスの人工合成法の開発(Kanai et al., 2017, PNAS, 114:2349-2354)
NHKニュース、TBSラジオ、朝日新聞、読売新聞、日本経済新聞、産経新聞、共同通信、Yahooニュース等、その他、国内外の多数のメディアに紹介されました。
RNAウイルスのリバースジェネティクス法は、プラスミドにクローン化したウイルスゲノム由来のcDNAなどを培養細胞に導入することで感染性の組換えウイルスを人工的に合成する技術です。この技術により、ウイルス遺伝子を任意に改変することが可能となり、ウイルス学研究の発展に大きく寄与してきました。ロタウイルスは乳幼児に下痢や嘔吐を引き起こすウイルスで、医療の発展が遅れている開発途上国では、ロタウイルス感染によって死亡する乳幼児が多く存在しています。ロタウイルスについては、これまで実用性の高いリバースジェネティクス法が確立されていなかったため、病原性解析や新規ワクチン開発の大きな障壁となっていました。
私達は、ロタウイルスの11分節のRNAゲノムを発現するプラスミドに加えて、組換えウイルスの人工合成を促進する因子として、細胞融合性タンパク質FAST(*1)とワクシニアウイルス由来のRNAキャッピング酵素(*2)を利用し、人工的に組換えロタウイルスを作製することに成功しました。さらに、この技術を応用し、抗インターフェロン作用を示すNSP1タンパク質に変異を加えることで増殖能が低下したロタウイルスや、ルシフェラーゼを発現するレポーターロタウイルスの作製に成功しました。
本研究成果により、ロタウイルス遺伝子の任意の改変が可能となり、ウイルス増殖機構の解明や、新規ロタウイルスワクチンの開発研究が飛躍的に進展することが期待されます。現行のロタウイルスワクチンとしては弱毒化した生ワクチンが世界的に利用されており、ロタウイルスによる乳幼児の死亡率低下に貢献しています。一方で、より安全で予防効果を向上させた新規ワクチンの開発も望まれています。これまでにない、ロタウイルスのリバースジェネティクス法の開発・技術により、任意の改変を加えることで人工的に病原性を制御したロタウイルスや、異なる国・地域で流行しているロタウイルス株に対して、より抗原性が適応したワクチン候補株を迅速に開発することが可能と考えられます。
(*1)FAST(Fusion Associated Small Transmembrane)タンパク レオウイルス科の一部のグループが持つ細胞融合性タンパク質。ロタウイルスもレオウイルス科に含まれる。ロタウイルス感染時にFASTを同時に発現することで、ロタウイルスの増殖が飛躍的に促進される。
(*2)RNAキャッピング酵素 ワクシニアウイルス由来のD1R, D12Lサブユニットから構成されるRNAキャッピング酵素により、細胞質内でロタウイルスRNAの5’末端にキャップ構造が付加されることで、RNAからタンパク質の翻訳効率が上昇する。
ネルソンベイレオウイルスの遺伝子操作系の確立
(Kawagishi et al., 2016, PLoS Pathogens, 12:e1005455)
ネルソンベイオルソレオウイルス(NBV)は1968年に初めてコウモリから分離されて以来、長らく非病原性のウイルスであると見なされてきました。 しかし、2000年代に入り、東南アジアを中心に重篤な呼吸器症状を呈した患者からNBVが相次いで分離されたことから、現在では新興の人獣共通感染症と考えられております。 これまでNBVの複製機構、病原性発現機構については解明が進んでおりませんでした。
本研究で私達は、遺伝子組換えNBVを人工的に作製することができるリバースジェネティクス(RG)系の確立に初めて成功しました。 RG系を用いてウイルス粒子表面に存在するσCの欠損ウイルス(σC-null)を作製し、解析した結果、σCはA549細胞のような一部の細胞株への感染には重要ですが、 L929細胞を含む多くの細胞株への感染には必要ではないことが明らかとなりました。 これらの結果は、NBVの感染にはσCに依存する経路と他のウイルスタンパク質(σB、μB等)によって介される経路が存在している可能性を示唆しています。 これまで、σCのみが細胞への吸着・侵入過程に関与していると考えられてきたことから、本研究の成果はレオウイルス科の感染機構を理解する上で重要な知見であると考えられます。 さらに、マウス感染モデルを用いてσCのin vivoにおける意義を調べたところ、in vitro(培養細胞)では必ずしも感染に必要ではないσCがin vivoではNBVの病原性発現に深く関与していることを明らかにしました。
これらの成果から、in vivoでのσC依存的な感染経路の重要性が明らかになるとともに、σCおよびσCに対する感染受容体を標的とした阻害薬の開発が感染制御において有効な戦略になるものと考えられます。
